蝙蝠「百毒不侵」的答案终于揭晓:清华等团队发现新冠病毒抑制剂
研究人员针对蝙蝠的两万多个基因组进行系统全面的筛查,确定了数十个病毒复制所依赖的关键蝙蝠基因,并发现了一个共同的新的宿主基因 MTHFD1。
结果证明,MTHFD1 确定为一种重要的病毒宿主因子,可能为开发广谱抗病毒药物打开新的机遇之门。
另外,MTHFD1 的抑制剂 carolacton 也被证明对一系列流行性病毒,包括新型冠状病毒有抑制作用。研究团队后续将在动物感染模型上进一步对 carolacton 及其衍生物的抗病毒功能进行临床前测试,希望能将其作为一种广谱抗病毒药物早日推向临床。
北京时间 3 月 31 日机器之心消息,清华大学结构生物学高精尖创新中心、杜克-新加坡国立大学医学院、中国疾控中心、中科院动物研究所、美国杜克大学的研究团队联合在论文预印本网站 BioRxiv 在线发表了一项最新研究,通过对蝙蝠对基因组分析,发现宿主蛋白 MTHFD1 的抑制剂 carolacton 可有效抑制新冠病毒复制。
该项研究发布于论文预印本网站 BioRxiv,题为《Orthogonal genome-wide screenings in bat cells identify MTHFD1 as a target of broad antiviral therapy」》,详述了抑制剂 carolacton 对发现过程和作用,该研究尚未经同行评议。

论文提到,蝙蝠是多种流行性病毒,如 SARS、埃博拉和病毒和近期持续性爆发的新型冠状病毒的天然宿主,但病毒自身却可以抵御这些病毒。
研究团队从蝙蝠基因组分析入手,使用了 RNAi 和 CRISPR 基因组学方法,系统地寻找病毒生命周期依赖的宿主因子,通过理解病毒-宿主因子的相互作用的分子机制来寻找新的抗病毒药物靶点。最后发现 c -1-四氢叶酸合酶基因 MTHFD1 在蝙蝠细胞和人类细胞中的病毒复制具有普遍依赖性。MTHFD1 抑制剂 carolacton 可有效阻断包括 SARS-CoV-2 在内的几种 RNA 病毒的复制。
carolacton 是一种天然产物,被作为抗生素候选分子,用于抑制细菌的菌膜生成。
他们认为,该研究成果不仅能助力新冠病毒药物研发,有力抗击疫情,更为人类未来抗击突发病毒流行打下基础。
清华大学结构生物学高精尖创新中心谭旭研究员和杜克-新加坡国立大学医学院王林发教授为论文的共同通讯作者。清华大学药学院博士生崔进、博士后叶倩、杜克-新加坡国立大学医学院 Danielle Anderson、中国疾控中心黄保英博士为论文的并列第一作者。该研究还得到了中国疾控中心谭文杰研究员、中科院动物所周旭明研究员、美国 Duke 大学的 So Young Kim 教授的帮助。
此外,谭旭实验室的这项工作由清华大学疫情防控科技攻关应急专项课题,北京市结构生物学高精尖创新中心、清华-北大生命科学联合中心和国家自然基金委优秀青年基金联合资助。
一 寻找蝙蝠中的病毒宿主
蝙蝠是一种具有独特行为和生理特征的有趣动物,它是唯一能飞行的哺乳动物,也是 SARS、埃博拉病毒等多种流行性疾病对天然宿主,但是这些病毒对蝙蝠自身毫无杀伤力。
人类对蝙蝠如何忍受这些病毒一直有极大对兴趣,据澎湃新闻报道,病毒专家证明,蝙蝠体内总是保持了一定量的干扰素表达。干扰素是一个很关键的抗病毒蛋白,如果它在身体中总是保持「低量」,就相当于动物本身具有「全天候保护」的防御机制。而研究蝙蝠携带病毒而不患病这一独特之处,有望让人类从中学习如何对抗病毒。
目前已经有一些研究基于基因组测序研究揭示了这种病毒感染耐受性背后的一些基因适应,但是要找到病毒感染蝙蝠细胞所需要的宿主因子还需要用基因组学方法对蝙蝠细胞进行全面排查。
宿主因子在对抗病毒对过程中非常重要。一般来说,由于多种病毒在细胞内复制需要很多共同的宿主蛋白才能完成复制周期,所以只有针对病毒复制依赖的宿主蛋白的新型抗病毒药物可能具有广谱性和不易产生耐药性的优点。
而传统的抗病毒药物以病毒蛋白作为靶点,它们在应对不断出现的多种不同类别的病毒时很难发挥作用,而且病毒也很容易通过突变自身基因而产生耐药性。
二 两条筛选路径,筛选两万多个基因
要系统的寻找蝙蝠中病毒生命周期依赖的宿主因子,就需要用先进对基因组工具对基因进行全面排查。研究人员建立了两个用于蝙蝠全基因组功能缺失筛选的数据库 CRISPR 和 RNAi,对两万多个蝙蝠基因进行了系统全面对筛查。
CRISPR 和 RNAi 是全新的基因组学方法,这两条途径中的不同基因正好反映了方法的互补性,RNAi 筛选有助于观察病毒感染的急性效应,而 CRISPR 筛选则有助于观察细胞存活的长期效应。
二者结合可以使全基因组筛选各种细胞类型的基因功能, 可以产生前所未有的丰富信息揭示宿主因素的复杂性,确定各种病毒的生物过程的优点和缺点, 从而理解病毒-宿主因子的相互作用的分子机制。
首先是在黑妖狐蝠肾上皮细胞(PaKi 细胞)中对 A 型流感病毒进行了 CRISPR 筛选,以识别病毒宿主因子。研究人员首先以高感染性物质杀死不成熟的 paki 细胞,然后收集存货细胞,并将 sgRNA 丰度与模拟感染细胞进行比较。最后用用 RIGER 算法计算结果,并确定了病毒感染或致病所需的 21 个宿主因子。
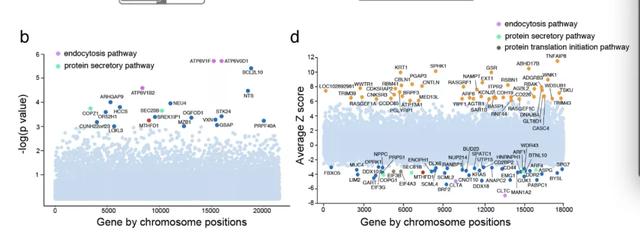
与此同时,杜克-新加坡国立大学医学院的王林发课题组在 PaKi 细胞中进行了 RNAi 筛选,以识别腮腺炎病毒 (一种副粘病毒) 感染的宿主因子。
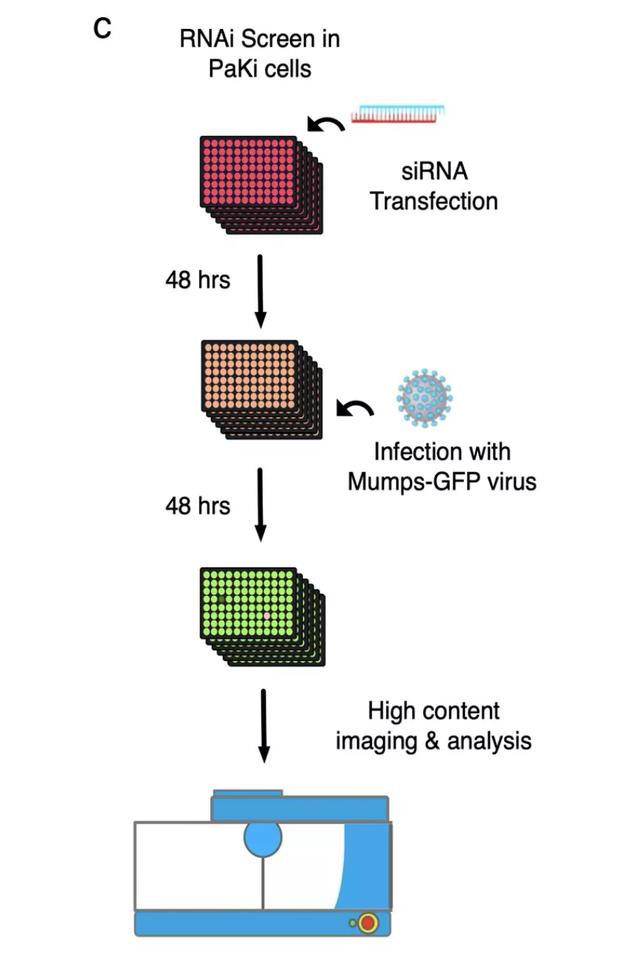
通过对两个课题组的筛选结果进行比较,研究团队发现其中都包括细胞内吞作用和蛋白分泌通路的重要基因,表明蝙蝠和人类细胞在宿主病毒感染的关键基因和途径上是相同的。
三 发现病毒宿主 MTHFD1,广谱抗病毒药物迎来新的机遇之门
这两种筛查都将 MTHFD1 确定为一种重要的病毒宿主因子。MTHFD1 是 C1 代谢的关键酶,负责产生嘌呤、dTMP 和甲基。
研究发现,在敲除 MTHFD1 后,人类细胞中的流感病毒、腮腺炎病毒在 PaKi 细胞中的复制和一种名为「Melaka 病毒」(PRV3M) 的鸟翼类原肠病毒 (pteropine orthorevirus) 均得到了抑制。
重要的是,宿主细胞对 MTHFD1 抑制的耐受性高于病毒,这可能为用抗病毒药物靶向 MTHFD1 提供了治疗窗口。
病毒感染将整个细胞机器转换成工厂,大规模生产子代病毒,这就解释了对 MTHFD1 的重要依赖。这类似于癌细胞对非致癌性药物的依赖,这些病毒对代谢性致癌性基因功能的依赖,如许多代谢酶,如 MTHFD1,可能为开发广谱抗病毒药物打开新的机遇之门。
有趣的是,以前所有使用人类细胞的 RNAi 和 CRISPR 筛选都没有发现 MTHFD1 是一个宿主因子。这可能与蝙蝠和人类启动子区域的差异有关,蝙蝠细胞和组织中 MTHFD1 的表达水平低于人类。
四 抑制剂carolacton对新冠病毒有抑制作用
研究进一步发现,MTHFD1 的抑制剂 carolacton 对于上述病毒的复制有非常强的抑制作用。这个现象在蝙蝠和人类细胞都很显著。
carolacton 是一种来自细菌的天然产物,研究团队测试了这种化合物对病毒复制的影响,发现即使很小的剂量也可以抑制寨卡病毒和腮腺炎病毒在 PaKi 细胞中的复制。
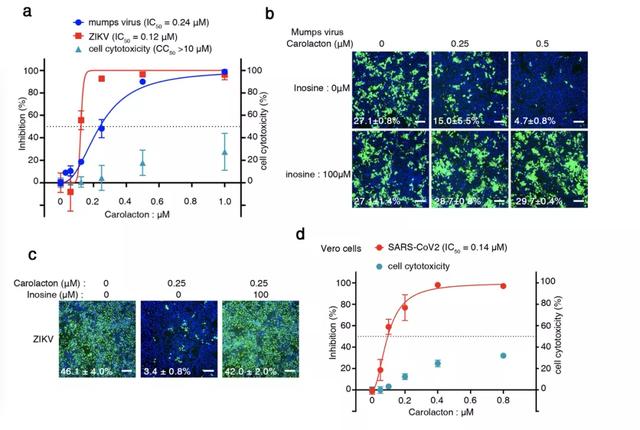
此外,测试还发现 carolacton 对新冠病毒的感染有抑制作用。抗病毒有效浓度远远低于细胞毒性浓度,展示出了良好的成药性。这一发现为该化合物对潜在临床应用提供了治疗窗口。
研究团队后续将在动物感染模型上进一步对 carolacton 及其衍生物的抗病毒功能进行临床前测试,希望能将其作为一种广谱抗病毒药物早日推向临床。MTHFD1 相关的基因对病毒的影响及其药物靶向的研究也有望提供更多的候选药物分子。

时间:2020-04-01 14:37 来源:可思数据 转发量:次
声明:本站部分作品是由网友自主投稿和发布、编辑整理上传,对此类作品本站仅提供交流平台,转载的目的在于传递更多信息及用于网络分享,并不代表本站赞同其观点和对其真实性负责,不为其版权负责。如果您发现网站上有侵犯您的知识产权的作品,请与我们取得联系,我们会及时修改或删除。
相关文章:
- [智慧医疗]watchOS 7.2 新增「心适能」 监测和分类心肺适能
- [智慧医疗]纽约医生告苹果 Watch 侵权,称「监测不规则脉搏
- [智慧医疗]名医神话将被智能医疗打破?美MIT教授:「诊疗
- [智慧医疗]离脑波「打字」更近!Facebook成功拆解大脑想法,
- [智慧医疗]开发AI医疗「鹰眼」!Google投资关键应用,提早一
- [智慧医疗]智能音箱可侦测「心脏病发」,美国大学新技术
- [智慧医疗]比日币一元还小!日本发明「可以吞」的微型体
- [智慧医疗]影像科刘再毅教授自述:为什么我是AI医疗的「旁
- [智慧医疗]斯坦福大学AI100报告 :「人工智能+医疗」五大场景
- [智慧医疗]人工智能「面诊」识别罕见遗传疾病,准确率可
相关推荐:
网友评论: